Sகேண்டியம்Sc என்ற தனிமச் சின்னத்தையும் அணு எண் 21 ஐயும் கொண்ட இது தண்ணீரில் எளிதில் கரையக்கூடியது, சூடான நீருடன் வினைபுரியக்கூடியது, மேலும் காற்றில் எளிதில் கருமையாகிறது. இதன் முக்கிய வேலன்ஸ் +3 ஆகும். இது பெரும்பாலும் காடோலினியம், எர்பியம் மற்றும் பிற தனிமங்களுடன் கலக்கப்படுகிறது, குறைந்த மகசூல் மற்றும் மேலோட்டத்தில் தோராயமாக 0.0005% உள்ளடக்கம் கொண்டது. ஸ்காண்டியம் பெரும்பாலும் சிறப்பு கண்ணாடி மற்றும் இலகுரக உயர் வெப்பநிலை உலோகக் கலவைகளை தயாரிக்கப் பயன்படுகிறது.
தற்போது, உலகில் ஸ்காண்டியத்தின் நிரூபிக்கப்பட்ட இருப்பு 2 மில்லியன் டன்கள் மட்டுமே, இதில் 90~95% பாக்சைட், பாஸ்போரைட் மற்றும் இரும்பு டைட்டானியம் தாதுக்களிலும், ஒரு சிறிய பகுதி யுரேனியம், தோரியம், டங்ஸ்டன் மற்றும் அரிய மண் தாதுக்களிலும் உள்ளன, அவை முக்கியமாக ரஷ்யா, சீனா, தஜிகிஸ்தான், மடகாஸ்கர், நோர்வே மற்றும் பிற நாடுகளில் விநியோகிக்கப்படுகின்றன. சீனா ஸ்காண்டியம் வளங்களில் மிகவும் வளமாக உள்ளது, ஸ்காண்டியத்துடன் தொடர்புடைய மிகப்பெரிய கனிம இருப்புக்கள் உள்ளன. முழுமையற்ற புள்ளிவிவரங்களின்படி, சீனாவில் ஸ்காண்டியத்தின் இருப்பு சுமார் 600000 டன்கள் ஆகும், அவை பாக்சைட் மற்றும் பாஸ்போரைட் வைப்புகளிலும், தெற்கு சீனாவில் போர்பிரி மற்றும் குவார்ட்ஸ் நரம்பு டங்ஸ்டன் வைப்புகளிலும், தெற்கு சீனாவில் அரிய மண் வைப்புகளிலும், உள் மங்கோலியாவில் பயான் ஓபோ அரிய மண் இரும்பு தாது வைப்புகளிலும், சிச்சுவானில் பன்ஷிஹுவா வெனடியம் டைட்டானியம் மேக்னடைட் வைப்புகளிலும் உள்ளன.
ஸ்காண்டியம் பற்றாக்குறையால், ஸ்காண்டியத்தின் விலையும் மிக அதிகமாக உள்ளது, மேலும் அதன் உச்சத்தில், ஸ்காண்டியத்தின் விலை தங்கத்தின் விலையை விட 10 மடங்கு அதிகமாக உயர்த்தப்பட்டது. ஸ்காண்டியம் விலை குறைந்திருந்தாலும், அது இன்னும் தங்கத்தின் விலையை விட நான்கு மடங்கு அதிகமாக உள்ளது!
வரலாற்றைக் கண்டறிதல்
1869 ஆம் ஆண்டில், மெண்டலீவ் கால்சியம் (40) மற்றும் டைட்டானியம் (48) ஆகியவற்றுக்கு இடையேயான அணு நிறை இடைவெளியைக் கவனித்தார், மேலும் இங்கு கண்டுபிடிக்கப்படாத ஒரு இடைநிலை அணு நிறை தனிமமும் இருப்பதாகக் கணித்தார். அதன் ஆக்சைடு X ₂ O Å என்று அவர் கணித்தார். ஸ்காண்டியம் 1879 ஆம் ஆண்டில் ஸ்வீடனில் உள்ள உப்சாலா பல்கலைக்கழகத்தைச் சேர்ந்த லார்ஸ் ஃபிரடெரிக் நில்சனால் கண்டுபிடிக்கப்பட்டது. அவர் அதை கருப்பு அரிய தங்கச் சுரங்கத்திலிருந்து பிரித்தெடுத்தார், இது 8 வகையான உலோக ஆக்சைடுகளைக் கொண்ட ஒரு சிக்கலான தாது. அவர் பிரித்தெடுத்துள்ளார்எர்பியம்(III) ஆக்சைடுகருப்பு அரிய தங்கத் தாதுவிலிருந்து, பெறப்பட்டதுஇட்டெர்பியம்(III) ஆக்சைடுஇந்த ஆக்சைடில் இருந்து, மற்றொரு இலகுவான தனிமத்தின் ஆக்சைடு உள்ளது, அதன் நிறமாலை இது ஒரு அறியப்படாத உலோகம் என்பதைக் காட்டுகிறது. இது மெண்டலீவ் கணித்த உலோகம், அதன் ஆக்சைடுஎஸ்சி₂ஓ₃. ஸ்காண்டியம் உலோகம் இதிலிருந்து தயாரிக்கப்பட்டதுஸ்காண்டியம் குளோரைடு1937 இல் மின்னாற்பகுப்பு உருகுவதன் மூலம்.
மெண்டலீவ்
எலக்ட்ரான் உள்ளமைவு
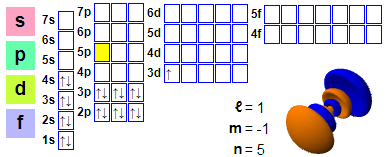
எலக்ட்ரான் உள்ளமைவு: 1s2 2s2 2p6 3s2 3p6 4s2 3d1
ஸ்காண்டியம் என்பது 1541 ℃ உருகுநிலை மற்றும் 2831 ℃ கொதிநிலை கொண்ட மென்மையான, வெள்ளி வெள்ளை நிற மாறுதல் உலோகமாகும்.
கண்டுபிடிக்கப்பட்ட பிறகு கணிசமான காலத்திற்கு, உற்பத்தியில் உள்ள சிரமம் காரணமாக ஸ்காண்டியத்தின் பயன்பாடு நிரூபிக்கப்படவில்லை. அரிய பூமி தனிமப் பிரிப்பு முறைகளின் அதிகரித்து வரும் முன்னேற்றத்துடன், ஸ்காண்டியம் சேர்மங்களை சுத்திகரிப்பதற்கான முதிர்ந்த செயல்முறை ஓட்டம் இப்போது உள்ளது. ஸ்காண்டியம் யட்ரியம் மற்றும் லாந்தனைடை விட குறைவான காரத்தன்மை கொண்டதாக இருப்பதால், ஹைட்ராக்சைடு பலவீனமானது, எனவே ஸ்காண்டியம்(III) ஹைட்ராக்சைடு கரைசலில் மாற்றப்பட்ட பிறகு அம்மோனியாவுடன் சிகிச்சையளிக்கப்படும்போது, ஸ்காண்டியம் கொண்ட அரிய பூமி தனிம கலப்பு கனிமம் "படி மழைப்பொழிவு" முறை மூலம் அரிய பூமி தனிமத்திலிருந்து பிரிக்கப்படும். மற்றொரு முறை நைட்ரேட்டின் துருவ சிதைவு மூலம் ஸ்காண்டியம் நைட்ரேட்டைப் பிரிப்பதாகும். ஸ்காண்டியம் நைட்ரேட் சிதைவதற்கு எளிதானது என்பதால், ஸ்காண்டியத்தைப் பிரிக்கலாம். கூடுதலாக, யுரேனியம், தோரியம், டங்ஸ்டன், தகரம் மற்றும் பிற கனிம வைப்புகளிலிருந்து ஸ்காண்டியத்தை விரிவாக மீட்டெடுப்பதும் ஸ்காண்டியத்தின் ஒரு முக்கிய மூலமாகும்.
தூய ஸ்காண்டியம் சேர்மத்தைப் பெற்ற பிறகு, அது ScCl Å ஆக மாற்றப்பட்டு, co KCl மற்றும் LiCl உடன் உருகப்படுகிறது. உருகிய துத்தநாகம் மின்னாற்பகுப்புக்கான கேத்தோடாகப் பயன்படுத்தப்படுகிறது, இதனால் ஸ்காண்டியம் துத்தநாக மின்முனையில் படிவுறுகிறது. பின்னர், துத்தநாகம் ஆவியாகி உலோக ஸ்காண்டியம் பெறப்படுகிறது. இது மிகவும் சுறுசுறுப்பான வேதியியல் பண்புகளைக் கொண்ட ஒரு இலகுரக வெள்ளி வெள்ளை உலோகமாகும், இது சூடான நீருடன் வினைபுரிந்து ஹைட்ரஜன் வாயுவை உருவாக்குகிறது. எனவே படத்தில் நீங்கள் காணும் உலோக ஸ்காண்டியம் ஒரு பாட்டிலில் அடைக்கப்பட்டு ஆர்கான் வாயுவால் பாதுகாக்கப்படுகிறது, இல்லையெனில் ஸ்காண்டியம் விரைவாக ஒரு அடர் மஞ்சள் அல்லது சாம்பல் நிற ஆக்சைடு அடுக்கை உருவாக்கி, அதன் பளபளப்பான உலோக பளபளப்பை இழக்கும்.
பயன்பாடுகள்
விளக்குத் தொழில்
ஸ்காண்டியத்தின் பயன்பாடுகள் மிகவும் பிரகாசமான திசைகளில் குவிந்துள்ளன, மேலும் அதை ஒளியின் மகன் என்று அழைப்பது மிகையாகாது. ஸ்காண்டியத்தின் முதல் மாய ஆயுதம் ஸ்காண்டியம் சோடியம் விளக்கு என்று அழைக்கப்படுகிறது, இது ஆயிரக்கணக்கான வீடுகளுக்கு ஒளியைக் கொண்டுவரப் பயன்படுகிறது. இது ஒரு உலோக ஹாலைடு மின்சார ஒளி: பல்பில் சோடியம் அயோடைடு மற்றும் ஸ்காண்டியம் ட்ரையோடைடு நிரப்பப்பட்டுள்ளன, மேலும் ஸ்காண்டியம் மற்றும் சோடியம் படலம் ஒரே நேரத்தில் சேர்க்கப்படுகின்றன. உயர் மின்னழுத்த வெளியேற்றத்தின் போது, ஸ்காண்டியம் அயனிகள் மற்றும் சோடியம் அயனிகள் முறையே அவற்றின் சிறப்பியல்பு உமிழ்வு அலைநீளங்களின் ஒளியை வெளியிடுகின்றன. சோடியத்தின் நிறமாலை கோடுகள் 589.0 மற்றும் 589.6 nm ஆகும், இரண்டு பிரபலமான மஞ்சள் விளக்குகள், அதே நேரத்தில் ஸ்காண்டியத்தின் நிறமாலை கோடுகள் 361.3~424.7 nm ஆகும், இது அருகிலுள்ள புற ஊதா மற்றும் நீல ஒளி உமிழ்வுகளின் தொடர். அவை ஒன்றையொன்று பூர்த்தி செய்வதால், உற்பத்தி செய்யப்படும் ஒட்டுமொத்த ஒளி நிறம் வெள்ளை ஒளி. ஸ்காண்டியம் சோடியம் விளக்குகள் அதிக ஒளிரும் திறன், நல்ல ஒளி நிறம், மின் சேமிப்பு, நீண்ட சேவை வாழ்க்கை மற்றும் வலுவான மூடுபனி உடைக்கும் திறன் போன்ற பண்புகளைக் கொண்டிருப்பதால், அவை தொலைக்காட்சி கேமராக்கள், சதுரங்கள், விளையாட்டு அரங்குகள் மற்றும் சாலை விளக்குகளுக்கு பரவலாகப் பயன்படுத்தப்படலாம், மேலும் அவை மூன்றாம் தலைமுறை ஒளி மூலங்கள் என்று அழைக்கப்படுகின்றன. சீனாவில், இந்த வகை விளக்கு படிப்படியாக ஒரு புதிய தொழில்நுட்பமாக ஊக்குவிக்கப்படுகிறது, அதே நேரத்தில் சில வளர்ந்த நாடுகளில், இந்த வகை விளக்கு 1980 களின் முற்பகுதியிலேயே பரவலாகப் பயன்படுத்தப்பட்டது.
ஸ்காண்டியத்தின் இரண்டாவது மாய ஆயுதம் சூரிய ஒளிமின்னழுத்த செல்கள் ஆகும், அவை தரையில் சிதறடிக்கப்பட்ட ஒளியைச் சேகரித்து அதை மின்சாரமாக மாற்றி மனித சமூகத்தை இயக்க முடியும். உலோக இன்சுலேட்டர் செமிகண்டக்டர் சிலிக்கான் சூரிய மின்கலங்கள் மற்றும் சூரிய மின்கலங்களில் ஸ்காண்டியம் சிறந்த தடை உலோகமாகும்.
இதன் மூன்றாவது மாய ஆயுதம் γ ஒரு கதிர் மூலம் என்று அழைக்கப்படுகிறது, இந்த மாய ஆயுதம் தானாகவே பிரகாசமாக பிரகாசிக்க முடியும், ஆனால் இந்த வகையான ஒளியை நிர்வாணக் கண்ணால் பெற முடியாது, இது ஒரு உயர் ஆற்றல் ஃபோட்டான் ஓட்டமாகும். நாம் வழக்கமாக தாதுக்களிலிருந்து 45Sc ஐப் பிரித்தெடுக்கிறோம், இது ஸ்காண்டியத்தின் ஒரே இயற்கை ஐசோடோப்புகள் ஆகும். ஒவ்வொரு 45Sc கருவிலும் 21 புரோட்டான்கள் மற்றும் 24 நியூட்ரான்கள் உள்ளன. 46Sc, ஒரு செயற்கை கதிரியக்க ஐசோடோப்பை, γ ஆகப் பயன்படுத்தலாம் கதிர்வீச்சு மூலங்கள் அல்லது ட்ரேசர் அணுக்கள் வீரியம் மிக்க கட்டிகளின் கதிரியக்க சிகிச்சைக்கும் பயன்படுத்தப்படலாம். யட்ரியம் காலியம் ஸ்காண்டியம் கார்னெட் லேசர் போன்ற பயன்பாடுகளும் உள்ளன,ஸ்காண்டியம் புளோரைடுகண்ணாடி அகச்சிவப்பு ஆப்டிகல் ஃபைபர், மற்றும் தொலைக்காட்சியில் ஸ்காண்டியம் பூசப்பட்ட கேத்தோடு கதிர் குழாய். ஸ்காண்டியம் பிரகாசத்துடன் பிறக்கிறது என்று தெரிகிறது.
உலோகக் கலவைத் தொழில்
அலுமினிய உலோகக் கலவைகளை ஊக்கமருந்து செய்வதற்கு அதன் தனிம வடிவமான ஸ்காண்டியம் பரவலாகப் பயன்படுத்தப்படுகிறது. அலுமினியத்தில் சில ஆயிரத்தில் ஒரு பங்கு ஸ்காண்டியம் சேர்க்கப்படும் வரை, ஒரு புதிய Al3Sc கட்டம் உருவாகும், இது அலுமினிய கலவையில் உருமாற்றப் பாத்திரத்தை வகிக்கும் மற்றும் அலாய்வின் அமைப்பு மற்றும் பண்புகளை கணிசமாக மாற்றும். 0.2%~0.4% Sc ஐச் சேர்ப்பது (இது வீட்டில் வறுத்த காய்கறிகளை கிளற உப்பு சேர்க்கும் விகிதத்திற்கு மிகவும் ஒத்திருக்கிறது, சிறிது மட்டுமே தேவைப்படும்) அலாய் மறுபடிகமாக்கல் வெப்பநிலையை 150-200 ℃ அதிகரிக்கலாம், மேலும் உயர் வெப்பநிலை வலிமை, கட்டமைப்பு நிலைத்தன்மை, வெல்டிங் செயல்திறன் மற்றும் அரிப்பு எதிர்ப்பை கணிசமாக மேம்படுத்தலாம். அதிக வெப்பநிலையில் நீண்ட கால வேலையின் போது எளிதில் ஏற்படும் சுருங்குதல் நிகழ்வையும் இது தவிர்க்கலாம். அதிக வலிமை மற்றும் அதிக கடினத்தன்மை கொண்ட அலுமினிய கலவை, புதிய அதிக வலிமை அரிப்பை எதிர்க்கும் வெல்டபிள் அலுமினிய கலவை, புதிய உயர் வெப்பநிலை அலுமினிய கலவை, அதிக வலிமை கொண்ட நியூட்ரான் கதிர்வீச்சு எதிர்ப்பு அலுமினிய கலவை போன்றவை விண்வெளி, விமானப் போக்குவரத்து, கப்பல்கள், அணு உலைகள், இலகுரக வாகனங்கள் மற்றும் அதிவேக ரயில்களில் மிகவும் கவர்ச்சிகரமான வளர்ச்சி வாய்ப்புகளைக் கொண்டுள்ளன.
ஸ்காண்டியம் இரும்புக்கு ஒரு சிறந்த மாற்றியமைப்பாளராகவும் உள்ளது, மேலும் ஒரு சிறிய அளவு ஸ்காண்டியம் வார்ப்பிரும்பின் வலிமை மற்றும் கடினத்தன்மையை கணிசமாக மேம்படுத்தும். கூடுதலாக, ஸ்காண்டியம் உயர் வெப்பநிலை டங்ஸ்டன் மற்றும் குரோமியம் உலோகக் கலவைகளுக்கு ஒரு சேர்க்கையாகவும் பயன்படுத்தப்படலாம். நிச்சயமாக, மற்றவர்களுக்கு திருமண ஆடைகளை தயாரிப்பதோடு மட்டுமல்லாமல், ஸ்காண்டியம் அதிக உருகுநிலையைக் கொண்டுள்ளது மற்றும் அதன் அடர்த்தி அலுமினியத்தைப் போன்றது, மேலும் ஸ்காண்டியம் டைட்டானியம் அலாய் மற்றும் ஸ்காண்டியம் மெக்னீசியம் அலாய் போன்ற உயர் உருகுநிலை இலகுரக உலோகக் கலவைகளிலும் பயன்படுத்தப்படுகிறது. இருப்பினும், அதன் அதிக விலை காரணமாக, இது பொதுவாக விண்வெளி விண்கலங்கள் மற்றும் ராக்கெட்டுகள் போன்ற உயர்நிலை உற்பத்தித் தொழில்களில் மட்டுமே பயன்படுத்தப்படுகிறது.
பீங்கான் பொருள்
ஸ்காண்டியம் என்ற ஒற்றைப் பொருள் பொதுவாக உலோகக் கலவைகளில் பயன்படுத்தப்படுகிறது, மேலும் அதன் ஆக்சைடுகள் பீங்கான் பொருட்களில் இதே வழியில் முக்கிய பங்கு வகிக்கின்றன. திட ஆக்சைடு எரிபொருள் செல்களுக்கு மின்முனைப் பொருளாகப் பயன்படுத்தக்கூடிய டெட்ராகோனல் சிர்கோனியா பீங்கான் பொருள், சுற்றுச்சூழலில் அதிகரிக்கும் வெப்பநிலை மற்றும் ஆக்ஸிஜன் செறிவுடன் இந்த எலக்ட்ரோலைட்டின் கடத்துத்திறன் அதிகரிக்கும் ஒரு தனித்துவமான பண்புகளைக் கொண்டுள்ளது. இருப்பினும், இந்த பீங்கான் பொருளின் படிக அமைப்பு நிலையானதாக இருக்க முடியாது மற்றும் தொழில்துறை மதிப்பைக் கொண்டிருக்கவில்லை; அதன் அசல் பண்புகளைப் பராமரிக்க இந்த கட்டமைப்பை சரிசெய்யக்கூடிய சில பொருட்களை ஊக்கமருந்து செய்வது அவசியம். 6~10% ஸ்காண்டியம் ஆக்சைடைச் சேர்ப்பது ஒரு கான்கிரீட் அமைப்பு போன்றது, இதனால் சிர்கோனியாவை ஒரு சதுர லட்டியில் நிலைப்படுத்த முடியும்.
அதிக வலிமை மற்றும் அதிக வெப்பநிலை எதிர்ப்பு சிலிக்கான் நைட்ரைடு போன்ற பொறியியல் பீங்கான் பொருட்களும் அடர்த்தியாக்கிகள் மற்றும் நிலைப்படுத்திகளாக உள்ளன.
அடர்த்தியாக்கியாக,ஸ்காண்டியம் ஆக்சைடுநுண்ணிய துகள்களின் விளிம்பில் ஒரு பயனற்ற கட்டம் Sc2Si2O7 ஐ உருவாக்க முடியும், இதனால் பொறியியல் மட்பாண்டங்களின் உயர்-வெப்பநிலை சிதைவைக் குறைக்கிறது. மற்ற ஆக்சைடுகளுடன் ஒப்பிடும்போது, இது சிலிக்கான் நைட்ரைட்டின் உயர்-வெப்பநிலை இயந்திர பண்புகளை சிறப்பாக மேம்படுத்த முடியும்.
வினையூக்க வேதியியல்
வேதியியல் பொறியியலில், ஸ்காண்டியம் பெரும்பாலும் ஒரு வினையூக்கியாகப் பயன்படுத்தப்படுகிறது, அதே நேரத்தில் Sc2O3 எத்தனால் அல்லது ஐசோபுரோபனாலின் நீரிழப்பு மற்றும் ஆக்ஸிஜனேற்றம், அசிட்டிக் அமிலத்தின் சிதைவு மற்றும் CO மற்றும் H2 இலிருந்து எத்திலீன் உற்பத்திக்கு பயன்படுத்தப்படலாம். Sc2O3 ஐக் கொண்ட Pt Al வினையூக்கி, பெட்ரோ கெமிக்கல் துறையில் கனரக எண்ணெய் ஹைட்ரஜனேற்றம் சுத்திகரிப்பு மற்றும் சுத்திகரிப்பு செயல்முறைகளுக்கு ஒரு முக்கியமான வினையூக்கியாகும். கியூமீன் போன்ற வினையூக்கி விரிசல் எதிர்வினைகளில், Sc-Y ஜியோலைட் வினையூக்கியின் செயல்பாடு அலுமினிய சிலிக்கேட் வினையூக்கியை விட 1000 மடங்கு அதிகமாகும்; சில பாரம்பரிய வினையூக்கிகளுடன் ஒப்பிடும்போது, ஸ்காண்டியம் வினையூக்கிகளின் வளர்ச்சி வாய்ப்புகள் மிகவும் பிரகாசமாக இருக்கும்.
அணுசக்தித் துறை
உயர் வெப்பநிலை உலை அணு எரிபொருளில் UO2 உடன் Sc2O3 ஐ ஒரு சிறிய அளவு சேர்ப்பதன் மூலம், UO2 ஐ U3O8 ஆக மாற்றுவதால் ஏற்படும் லேட்டிஸ் மாற்றம், அளவு அதிகரிப்பு மற்றும் விரிசல் ஆகியவற்றைத் தவிர்க்கலாம்.
எரிபொருள் செல்
இதேபோல், நிக்கல் ஆல்காலி பேட்டரிகளில் 2.5% முதல் 25% வரை ஸ்காண்டியம் சேர்ப்பது அவற்றின் சேவை வாழ்க்கையை அதிகரிக்கும்.
விவசாய இனப்பெருக்கம்
விவசாயத்தில், சோளம், பீட்ரூட், பட்டாணி, கோதுமை மற்றும் சூரியகாந்தி போன்ற விதைகளை ஸ்காண்டியம் சல்பேட்டுடன் சிகிச்சையளிக்கலாம் (செறிவு பொதுவாக 10-3~10-8mol/L, வெவ்வேறு தாவரங்கள் வேறுபட்டதாக இருக்கும்), மேலும் முளைப்பதை ஊக்குவிப்பதன் உண்மையான விளைவு அடையப்பட்டுள்ளது. 8 மணி நேரத்திற்குப் பிறகு, நாற்றுகளுடன் ஒப்பிடும்போது வேர்கள் மற்றும் மொட்டுகளின் உலர்ந்த எடை முறையே 37% மற்றும் 78% அதிகரித்துள்ளது, ஆனால் வழிமுறை இன்னும் ஆய்வில் உள்ளது.
அணு நிறை தரவுகளின் கடனில் நீல்சனின் கவனத்திலிருந்து இன்று வரை, ஸ்காண்டியம் நூறு அல்லது இருபது ஆண்டுகளாக மட்டுமே மக்களின் பார்வையில் நுழைந்துள்ளது, ஆனால் அது கிட்டத்தட்ட நூறு ஆண்டுகளாகவே அமர்வில் அமர்ந்திருக்கிறது. கடந்த நூற்றாண்டின் பிற்பகுதியில் பொருள் அறிவியலின் தீவிர வளர்ச்சி வரை அது அவருக்கு உயிர்ச்சக்தியைக் கொண்டு வந்தது. இன்று, ஸ்காண்டியம் உள்ளிட்ட அரிய பூமி கூறுகள் பொருள் அறிவியலில் சூடான நட்சத்திரங்களாக மாறிவிட்டன, ஆயிரக்கணக்கான அமைப்புகளில் எப்போதும் மாறிவரும் பாத்திரங்களை வகிக்கின்றன, ஒவ்வொரு நாளும் நம் வாழ்வில் அதிக வசதியைக் கொண்டு வருகின்றன, மேலும் அளவிட இன்னும் கடினமான பொருளாதார மதிப்பை உருவாக்குகின்றன.
இடுகை நேரம்: ஜூன்-29-2023